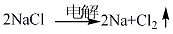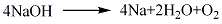化學(xué)性質(zhì)
1.化學(xué)性質(zhì)極活潑���,能與許多有機(jī)物及無(wú)機(jī)物發(fā)生反應(yīng)���;與金屬或非金屬可直接化合,如與鉛生成鉛鈉合金�、與汞生成鈉汞齊等。在空氣中急速氧化�。燃燒時(shí)呈黃色火焰���。與皮膚接觸易引起燒傷��。 遇醇分解�,不溶于醚和苯����。常溫時(shí)為蠟狀�,易用刀切開(kāi)。其蒸氣帶有紫色���,高溫時(shí)呈黃色����,有極好的傳熱性�����。新切面有光澤����,在空氣中氧化轉(zhuǎn)變?yōu)榘祷疑Y|(zhì)軟而輕����,在-20℃時(shí)變硬���。遇水劇烈分解�����,生成氫氧化鈉和氫氣并產(chǎn)生熱量而自燃或爆炸����。燃燒時(shí)發(fā)亮黃色火焰��。與鹵素和磷直接化合�����。能還原許多氧化物成元素狀態(tài)�,也能還原金屬氯化物。溶于液氨時(shí)成藍(lán)色溶液�����。在氨中加熱生成氨基鈉。溶于汞生成鈉汞齊��。
2.熔點(diǎn)(℃):97.8[2]
3.沸點(diǎn)(℃):881.4~892[3]
4.相對(duì)密度(水=1):0.97[4]
5.飽和蒸氣壓(kPa):0.16(440℃)[5]
6.燃燒熱(kJ/mol):-209.5[6]
7.臨界壓力(MPa):34.7[7]
8.辛醇/水分配系數(shù):-0.77[8]
9.引燃溫度(℃):>115[9]
10.溶解性:不溶于煤油���、乙醚���、苯�,溶于液氨�����。[10]
毒理學(xué)數(shù)據(jù)
1.急性毒性[11] LD50:4000mg/kg(小鼠腹腔)
2.刺激性 暫無(wú)資料
生態(tài)學(xué)數(shù)據(jù)
1.生態(tài)毒性 暫無(wú)資料
2.生物降解性 暫無(wú)資料
3.非生物降解性 暫無(wú)資料
4.其他有害作用[12] 該物質(zhì)對(duì)環(huán)境有危害����,應(yīng)特別注意對(duì)水體的污染。
安全信息
危險(xiǎn)運(yùn)輸編碼:UN 1428 4.3/PG 1
危險(xiǎn)品標(biāo)志: 易燃
易燃  腐蝕
腐蝕
安全標(biāo)識(shí):S8 S43 S45
危險(xiǎn)標(biāo)識(shí):R34 R14/15
合成方法
1.將含有氯化鈉33%�、氯化鍶24%���、氯化鈣28%��、氯化鋇15%的四元點(diǎn)解質(zhì)經(jīng)干燥脫水精制后進(jìn)行電解����。
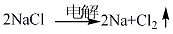
電解溫度控制在590-630 oC����,槽電流強(qiáng)度24000A、槽電壓605-705V�����,陰極電流密度0.97A/cm2���、陽(yáng)極電流密度1A/cm2 ���。陰極收集到的粗鈉于120-150 oC進(jìn)行熔化、澄清�,上層清液即為精制鈉�����。下層殘液經(jīng)蒸餾可回收鈉�����。陰極收集鈉需用氮?dú)夥雷o(hù)�����。方法2:經(jīng)精制后的二元電解質(zhì)氫氧化鈉和碳酸鈉進(jìn)行電解,溫度為285-305 oC�,槽電流強(qiáng)度為2500A,槽電壓4.5-5V,陽(yáng)極電流密度0.89A/cm2�����,陰極電流密度0.94-1.03A/ cm2����。陰極手機(jī)的粗鈉于110-120 oC精制得成品。
2.用堿金屬的疊氮化合物在高真空下加熱分解����,可以制得很純的不含氣體的堿金屬。
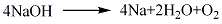
分解疊氮化合物的儀器裝置如圖I-8所示:
圖I-8 由疊氮化物制取堿金屬的裝置
1--分解反應(yīng)管����;2,3--冷阱����;4--汞封活門��;5,6--接受器�����;7,8--燒封處�;9--盛裝制得的金屬用的安瓿
儀器是由在高溫下能夠耐堿腐蝕的硬質(zhì)玻璃制成。為防止由于疊氮化合物的分解而引起裝置內(nèi)的壓力突然升高�,所有導(dǎo)管的直徑都應(yīng)大于12~16mm。將疊氮化合物在瑪瑙研缽中研細(xì)�,裝入分解反應(yīng)管中,約占反應(yīng)體積的1/4�����,使其均勻分布����,然后將反應(yīng)管與整個(gè)裝置熔接在一起,反應(yīng)管放在電熱套中����,將蓋斯勒(Geisler)放電管真空規(guī)與裝置妥善連接�,兩個(gè)冷阱均浸入液化空氣中�����。開(kāi)啟前級(jí)真空泵將裝置抽真空,并加熱至200℃���,保溫12h��,若放電管中無(wú)放電現(xiàn)象�,說(shuō)明裝置中達(dá)到并維持良好的真空狀�。調(diào)高電爐的溫度使之逐漸升至275℃(疊氮化鈉的分解溫度),關(guān)閉汞封活門4��,不致使疊氮化物分解時(shí)放出的N2將疊氮化物挾帶至接受器5中�����,與金屬鈉混雜在一起�。一旦分解反應(yīng)開(kāi)始,裝置內(nèi)的壓力會(huì)突然增高��,為了減低壓力,要調(diào)低溫度�����,同時(shí)打開(kāi)聯(lián)接緩沖容器的閥門(緩沖容器是一個(gè)用前級(jí)真空泵已抽成真空的8L的圓底燒瓶)�。另外還要注意避免疊氮化合物因過(guò)熱而引起的爆炸性分解,而將裝置炸碎����。當(dāng)蓋斯勒放電管中放電現(xiàn)象消失時(shí)�����,標(biāo)志分解反應(yīng)完成��。金屬鈉由反應(yīng)管被蒸餾到接受器6中��,在聯(lián)接管7處將反應(yīng)管1熔封拉下�����,同時(shí)將導(dǎo)管8熔封�����,隔斷前級(jí)真空,開(kāi)啟高真空泵��,并打開(kāi)汞封活門4����,加熱接受器6,使更純的金屬鈉進(jìn)入5�。將5中的金屬鈉熔融,金屬鈉即流入安瓿9�����,最后將安瓿的熔封拉下���,純金屬鈉即在真空安瓿中保存�。
3.用鋯還原制取金屬鈉�����。因?yàn)樵谥苽溥^(guò)程中不與氣體接觸�����,因此不含反復(fù)真空蒸餾也難于去除的氣體�����,可以保證金屬鈉的純度��。所用原料為堿金屬的鉻酸鹽或重鉻酸鹽����、鉬酸鹽�、鎢酸鹽與鋯粉�。Na2MoO4或Na2WO4與Zr粉的質(zhì)量比為1∶4,將兩者的細(xì)粉末混合均勻�,壓成小棒狀,放在一根已加熱排過(guò)氣體的石英管中�����,然后抽到高真空���,加熱至約550℃(Na2WO4為450℃)A�,B—燒瓶生分解反應(yīng)�����。得到的金屬鈉凝附在石英管壁上溫度較低的部分�����。用鉬酸鈉Na2MoO4作原料時(shí)得到的金屬鈉的產(chǎn)率幾乎為理論量��。
鈉的提純方法:用真空蒸餾法將金屬鈉提純����。
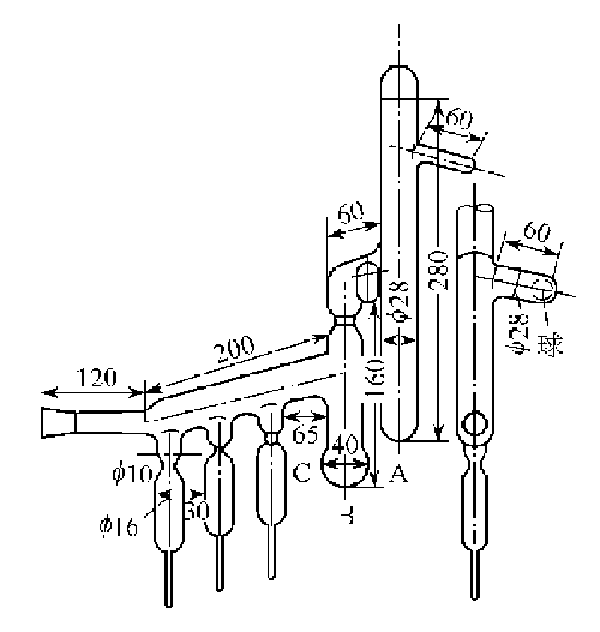
圖I-9 鈉的蒸餾裝置(圖中單位為毫米)A,B--燒瓶
將裝置抽真空,同時(shí)加熱1~2h使其干燥�,然后充入無(wú)氧無(wú)水的高純氬氣����。在干燥箱中除去金屬鈉表層的氧化物,截下燒瓶A的頂端將處理好的金屬鈉裝入燒瓶A中���,熔封截口��。抽真空��,將真空度達(dá)到10-3~10-4Pa時(shí)加熱裝置����,燒瓶A中的金屬鈉被蒸餾流向B中。燒瓶A中的殘留物用球封住���。調(diào)節(jié)溫度使燒瓶B中的金屬鈉被蒸餾逐滴滴入安瓿中���。蒸餾完畢,待裝置冷卻充入氬氣�,將安瓿熔封切斷,金屬鈉即可在充有氬氣的安瓿中保存����。
4.方法一:取比需用覺(jué)多一點(diǎn)的鈉放在廠’口錐形瓶或高燒杯中��,用干燥二甲苯復(fù)蓋�。將瓶加熱至鈉熔融而留下表面氧化物殼皮。移去熱源���,溫和地旋動(dòng)瓶子使鈉生成若干球體���。然后將瓶在不太攪動(dòng)的情況下冷卻以免鈉球又結(jié)在一起����。在冷卻過(guò)程中向溶劑中通入氮?dú)?����。待鈉固化后�,用一支尖銳的鐵絲或其它器械取出清潔的球休,迅速用濾紙拭干��,放在容器中���。氧化物殼皮中只含很少的鈉�,傾去溶劑,用叔了醇處理使之與殘留的鈉相作用�。在裝有短的回流冷凝器和強(qiáng)力機(jī)械攪拌器的2升兩頸燒瓶中,放400毫升干燥二甲苯和29克(1.26克原子)上述方法制得的金屬鈉球體或小塊�����。把燒瓶放在油浴中加熱,使金屬鈉完全熔融��。開(kāi)動(dòng)攪拌器使金屬鈉粉碎成很小的顆粒�,移去油浴,但繼續(xù)攪拌���,直到金屬鈉凝固成很細(xì)的顆粒為止����。然后傾出二甲苯�。方法二:取100毫升園底燒瓶,安裝冷凝器���,上附一鈉石灰干燥管��。將2克切去外皮的潔凈金屬鈉切成小片�����,放入瓶?jī)?nèi)�,并加入無(wú)水二甲苯復(fù)蓋,于油浴內(nèi)加熱近佛騰����。移去油浴�,迅速將瓶取下���,用塞子塞緊���,并用雙層毛巾或布包裹����,用力搖幾下,即成細(xì)小鈉砂���。
上下游產(chǎn)品信息
表征圖譜
相關(guān)文獻(xiàn)
用途
1.測(cè)定有機(jī)物中的氯�,還原和氫化有機(jī)化合物�,檢驗(yàn)有機(jī)物中的氮、硫���、氟����。去除有機(jī)溶劑(苯����、烴����、醚)中的水分,除去烴中的氧�、碘或氫碘酸等雜質(zhì)。
2.制備鈉汞齊�����、醇化鈉���、純氫氧化鈉��、過(guò)氧化鈉�、氨基鈉等�。
3.冶金工業(yè)用于還原鈦、鋯等金屬氧化物���?���?捎糜谏a(chǎn)汽油抗震劑四乙基鉛���。煉油工業(yè)用作油品的脫硫劑��。無(wú)機(jī)工業(yè)用于制造氰化鈉����、過(guò)氧化鈉�����、氨基鈉等����。在工業(yè)上用作強(qiáng)力還原劑和脫水劑。利用金屬鈉較好的導(dǎo)電性能���,可制造電纜�����。添加于鋁中可增加硬度�����,用以制造車輛軸承合金����。電光源工業(yè)用于制造單色光源鈉光燈。醫(yī)藥工業(yè)用于生產(chǎn)西力生��、維生素B1�、咖啡因及其他醫(yī)藥產(chǎn)品。也用于合成靛藍(lán)染料和染料中間體,還用作合成橡膠的催化劑���。原子能工業(yè)用作原子能高速增殖爐的冷卻劑。
4.用作分析試劑���。制備鈉化合物及合金�����。在工業(yè)上用作強(qiáng)力還原劑和脫水劑����,合成橡膠的催化劑�����、石油的脫硫劑����。
5.用于制造氰化鈉、過(guò)氧化鈉和多種化學(xué)藥物�,也用作還原劑。



 易燃
易燃  腐蝕
腐蝕